Biophysik und Photosyntheseforschung
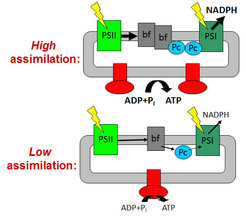
Dabei konnte gezeigt werden, dass die photosynthetische ATP- und NADPH-Produktion primär über Änderungen im Gehalt von Cytochrom-b6f Komplex, Plastocyanin und ATP-Synthase an den metabolischen Bedarf angepasst wird, während sich die Gehalte beider Photosysteme nur geringfügig ändern. Ist die Anpassung der Lichtreaktion an den metabolischen Bedarf in Mutanten gestört, kommt es zu einer vermehrten Produktion von Sauerstoffradikalen und zur oxidativen Zerstörung des Photosynthese-Apparates. Von diesen Beobachtungen ausgehend verfolgt die Gruppe derzeit drei Hauptprojekte.
1. Welche Signale lösen eine Anpassung des Photosyntheseapparates an den metabolischen Bedarf aus?
Durch Messungen an Mutanten mit Störungen im Calvin-Zyklus, im Photoassimilat-Export aus den Blättern und an Phytohormon-Mutanten konnten wir zeigen, dass der Assimilat-Gehalt der Blätter perzipiert wird. Eine Photoassimilat-Akkumulation reprimiert spezifisch die Biogenese von Cytochrom-b6f Komplex und ATP-Synthase. Die generelle, systemische Anpassung der Photosynthesekapazität der Blätter an den metabolischen Bedarf der wachsenden Gewebe und Speicherorgane erfolgt über Phytohormone.
2. Wie beeinflussen diese Signale die Akkumulation der Photosynthesekomplexe?
Wir untersuchen, ob die metabolischen Signale und Phytohormone vor allem auf die Transkription, Transkript-Prozessierung, oder auf Translation und Assemblierung der Photosynthesekomplexe Einfluss nehmen. Außerdem wird in diesem Teilprojekt die Funktion neu identifizierter Chaperone der Photosystem I-Biogenese detailliert charakterisiert.
3.Welche Lebensdauern haben die verschiedenen Photosynthesekomplexe?
Mit Ausnahme des detailliert charakterisierten Reparaturzyklus von Photosystem II ist sehr wenig über die Stabilität und Lebensdauer der anderen Photosynthesekomplexe in höheren Pflanzen bekannt. Daher verwenden wir die induzierbare RNAi-Repression essentieller kernkodierter Untereinheiten, um spezifisch die de novo-Biogenese eines Komplexes zu unterdrücken. Der Abbau / Verlust des Komplexes nach RNAi-Induktion wird in ausgewachsenen Blättern, deren Photosyntheseapparat bereits voll entwickelt ist, nicht invasiv mittels spektrokopischer Methoden verfolgt. Hieraus wird die Lebensdauer der Komplexe abgeleitet. Während einige Komplexe innerhalb weniger Tage nach RNAi-Induktion komplett degradiert werden, weisen andere Komplexe Lebensdauern von mehreren Wochen auf.
4. Wie groß ist der Beitrag der einzelnen Photosynthesekomplexe zur photosynthetischen Flusskontrolle und zur Thylakoidstruktur?
Um die Beiträge der verschiedenen Komponenten des Photosyntheseapparates zur photosynthetischen Flusskontrolle zu bestimmen, werden ihre Gehalte mit Hilfe transgener und transplastomischer (genetisch veränderte Plastiden) Ansätze verändert. Die Auswirkungen der veränderten Komplexgehalte auf den Elektronentransport, die Assimilationskapazität, aber auch auf die Thylakoidstruktur und das Diffusionsverhalten der Proteinkomplexe und der Redoxcarrier Plastocyanin und Plastochinon werden bestimmt.



