Regulation des pflanzlichen Phosphat-Haushalts
Forschungsbericht (importiert) 2008 - Max-Planck-Institut für Molekulare Pflanzenphysiologie
Pflanzen können sich an Phosphatmangel anpassen
Anorganisches Phosphat (Pi) ist ein essentieller Makronährstoff für Tier und Pflanze. Es ist beteiligt an vielerlei biologischen Prozessen wie zum Beispiel der pflanzlichen Photosynthese, dem Zucker- und Energiestoffwechsel oder auch der Signaltransduktion. Phosphat ist auch grundlegender Bestandteil der Nukleinsäuren DNA und RNA sowie der Zellmembranen. In der Landwirtschaft wird mit anorganischem Phosphat gedüngt, um hohe Erträge zu garantieren. Die hochwertigen, leicht abbaubaren Phosphatvorräte auf der Erde gehen allerdings zurück. Experten sind der Ansicht, dass diese Vorräte in 50 bis 100 Jahren zur Neige gehen werden. Viele Böden in Europa und anderen Teilen der Erde sind arm an pflanzenverfügbarem Pi, sodass ein Phosphatmangel weit verbreitet ist. Der Erforschung der Regulation des pflanzlichen Phosphat-Haushalts kommt deshalb eine ganz besondere Bedeutung zu.
Unter Pi-Mangelsituationen können Pflanzen sich organisch gebundenes Phosphat oder im Boden komplexiertes (Eisen- oder Kalzium-Pi-Komplexe) verfügbar machen. Dies erfolgt durch eine vermehrte Produktion und Sekretion organischer Säuren, Ribonukleasen oder Phosphatasen und die starke Expression von speziellen Pi-Transportern. Eine andere Möglichkeit besteht für bestimmte Pflanzenarten auch darin, eine Symbiose mit Mykorrhizapilzen einzugehen, wobei die Pflanzen Pi erhalten und den Pilzen im Gegenzug Assimilate (Zucker) liefern. Eine dritte Strategie beruht darauf, interne Phosphat-Pools effizienter zu nutzen. So erfolgt unter Pi-Mangelbedingungen in den Zellmembranen der Austausch von Phospholipiden gegen Glykolipide, eine beschleunigte Seneszenz älterer Pflanzenteile und eine Verringerung des zellulären RNA-Gehalts, wodurch Pi-haltige Verbindungen frei und wieder verwertbar werden. Neben diesen Strategien zur verbesserten Pi-Aufnahme und internen Mobilisation besteht eine weitere wichtige Aufgabe darin, besonders die wachsenden und reproduktiven Organe mit Phosphat zu versorgen, um so die pflanzliche Reproduktion und das Überleben zu gewährleisten.
Identifizierung und Charakterisierung der molekularen Mitspieler
Bei Untersuchungen an so genannten pho2 -Mutanten von Arabidopsis thaliana zeigte sich, dass diese bei Wachstum in phosphathaltigem Kultursubstrat einen im Vergleich zum Wildtyp ungefähr 3 bis 5fach erhöhten Pi-Gehalt in den Blättern und den reproduktiven Geweben aufwiesen. Der Pi-Gehalt der Wurzeln blieb dagegen unverändert [1]. Die Phosphat-Homöostase ist in dieser Mutante also verändert. Zur Klärung der Frage, worauf diese Veränderung beruht, wurde die pho2-Mutante mittels Transkriptom-Analyse, das heißt mittels einer genomweiten Untersuchung der Genexpression charakterisiert. Es zeigte sich, dass eine ganze Anzahl von Genen, die in Wildtyp-Pflanzen normalerweise nur während Pi-Stress verstärkt exprimiert sind (z. B. Gene, die Pi-Transporter oder Phosphatasen kodieren [2]), in der Mutante auch unter Pi-reichen Bedingungen angeschaltet bleiben [3]. Dieses Ergebnis liefert eine einfache Erklärung für die erhöhten Pi-Gehalte und lässt darauf schließen, dass in der pho2-Mutante eine bei Pi-Mangel wichtige Signaltransduktionskette andauernd aktiv ist, während sie beim Wildtyp bei Pi-Mangel erst angeschaltet wird.
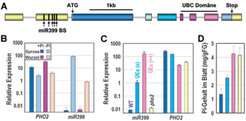
Zur Identifikation des genetischen Defektes der pho2-Mutante wurde die Methode der kartengestützten Klonierung [4] angewendet. Dadurch konnte ein Gen identifiziert werden, das ein Ubiquitin-konjugierendes Protein, eine so genannte E2-Konjugase, kodiert [3] (Abb. 1A).
Proteine, die durch Konjugation mit Ubiquitin markiert werden, unterliegen einem geregelten Abbau. Die Erkenntnis, dass geregelter Proteinabbau mittels Ubiquitinierung an der Regulation von Nährstoffaufnahme oder -verteilung beteiligt ist, war bis dahin unbekannt.
Ferner wurde anhand von Sequenzvergleichen klar, dass das PHO2-Gen/Protein nur in höheren vaskulären Pflanzen – also in Pflanzen mit Leitgefäßen – vorhanden ist, nicht aber in niederen photosynthetischen Organismen (wie beispielsweise Chlamydomonas reinhardtii, Physcomitrella patens) auftritt. Dies legt für PHO2 eine über einzelne Zellen hinausgehende Funktion nahe, wie es für einen Schlüsselregulator der Phosphat-Homöostase zu erwarten ist.
Die Analyse der PHO2-Gensequenz lieferte eine weitere bedeutungsvolle Beobachtung. Im Bereich des PHO2-Transkripts, der direkt vor dem Translations-Startpunkt liegt, befinden sich fünf fast identische 21 Nukleotide lange Abschnitte, welche sich in ihrer Sequenz als komplementär zu einer zu diesem Zeitpunkt zwar vorhergesagten, aber nicht näher charakterisierten pflanzlichen mikroRNA (miR399) herausstellten (Abb. 1A). Die lediglich 21-24 Nukleotide langen mikroRNAs wurden innerhalb der letzten Jahre als wichtige Regulatoren in nahezu allen untersuchten höheren Organismen nachgewiesen. Sie hemmen die Aktivität ihrer Zielgene, indem sie entweder den Abbau ihrer Transkripte einleiten oder die Translation der Transkripte verringern.
Im Genom von Arabidopsis thaliana ist die miR399 selbst durch fünf Gene kodiert, und Experimente ergaben, dass alle fünf Gene unter Pi-Mangelbedingungen stark exprimiert werden, wodurch sowohl die primären miR399-Transkripte als auch die daraus zurechtgeschnittenen, 21 Nukleotide langen, reifen miR399-Moleküle extrem zahlreich sind (Abb. 1B). Hingegen ist eine Expression der Gene in Pi-versorgten Pflanzen selbst mit sehr sensitiven Methoden (quantitative Echtzeit-PCR; [5]) kaum nachzuweisen [3, 6], (Abb. 1B). Bei starker konstitutiver Überexpression der miR399 mittels transgener Ansätze in Arabidopsis (Abb. 1C) und Tabak zeigte sich ferner, dass diese Pflanzen in ihren Blättern genau wie pho2-Mutanten Phosphat akkumulieren (Abb. 1D). Ebenso ist das PHO2- Transkript in diesen miR399-überexprimierenden Pflanzen etwa 5 bis 10fach reduziert. MiR399 stellt damit einen durch den pflanzlichen Pi-Status regulierten molekularen Schalter dar, der die Expression des PHO2-Gens kontrolliert bzw. unterdrückt.
MikroRNA399 ist ein Langstreckensignal für die Regulation der Phosphat-Homöostase
Genexpressions-Messungen zeigten, dass die Induktion der miR399-kodierenden Gene unter Pi-Mangel in Blättern sehr viel stärker ist als in Wurzeln (Abb. 1B).
Pfropfungsversuche (engl. grafting) mit Arabidopsis zeigten außerdem, dass ein PHO2-Gendefekt in den Wurzeln notwendig und ausreichend ist, um die Pi-Anhäufung in den Blättern auszulösen, während der PHO2-Gendefekt im Spross keinen Einfluss auf die Pi-Akkumulation zeigte [3], (Abb. 2).
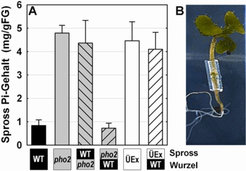
Diese Befunde führten zu der Hypothese, dass miR399 per se ein Pi-Mangelsignal darstellt und von den Blättern über das pflanzliche Leitgewebe (Phloem) in die Wurzeln transportiert wird, wo miR399 zur Inaktivierung von PHO2 und zu verstärkter Pi-Aufnahme und verstärktem Pi-Transport in die Blätter führt (Abb. 3).
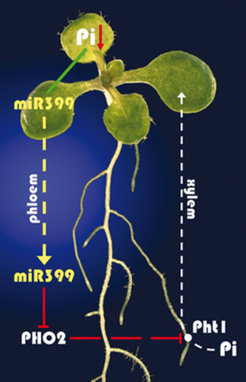
Zum Beleg dieser Hypothese zeigten die Wissenschaftler am MPI für molekulare Pflanzenphysiologie zuerst, dass miR399 im pflanzlichen Phloemsaft auftritt und auch dort während Pi-Mangelbedingungen sehr stark ansteigt [6]. Anschließend wurden mittels Pfropfung chimäre Arabidopsis-Pflanzen hergestellt, die eine Wildtyp-Wurzel besaßen, aber im transgenen Spross miR399 konstitutiv überexprimierten [6], (Abb. 2). In den Wurzeln dieser Pflanzen waren die miR399-Gene inaktiv, aber die reife miR399 war sehr stark vorhanden. Außerdem war das PHO2-Transkript wiederum 5 bis 10fach reduziert und die chimären Pflanzen akkumulierten Phosphat in den Blättern (Abb. 2). Mit diesen und weiteren Ergebnissen erfolgte schließlich die Bestätigung des aufgestellten Modells (Abb. 3) und der erste Nachweis einer mikroRNA als systemisches Signal.
Ausblick
Auf Grundlage der durchgeführten Experimente konnten die Modellvorstellungen zur internen Pi-Verteilung bei Pi-Mangel maßgeblich erweitert und miR399 als molekularer Schalter für die pflanzliche Pi-Versorgung/Verteilung identifiziert werden. Außerdem lieferten die Ergebnisse neue Denkansätze bezüglich der pflanzlichen Signaltransduktion unter Nährstoff-Stressbedingungen. In weitergehenden Forschungen beschäftigen sich die Wissenschaftler in Potsdam nun mit der Aufklärung der breiteren funktionellen Bedeutung von mikroRNAs, nicht-proteinkodierenden Ribonukleinsäuren und des Ubiquitin-abhängigen, gezielten Proteinabbauweges bei Nährstoffstress in Pflanzen.


