Zwei Skelette treffen sich: die pflanzliche Zellwand und das Zytoskelett
Forschungsbericht (importiert) 2010 - Max-Planck-Institut für Molekulare Pflanzenphysiologie
Zellulosesynthese in der pflanzlichen Zellwand
Die pflanzliche Zellwand ist hauptsächlich aus vernetzten Kohlenhydrat-Ketten aufgebaut, die einen sowohl dynamischen als auch tragfähigen Verbund bilden. Die Zellwand ist von enormer Wichtigkeit für die Pflanze, da sie einerseits zur strukturellen Unterstützung des Wachstums beiträgt und andererseits als Schutzbarriere gegen schädigende Umwelteinflüsse dient. Abhängig von Struktur und Anteil werden die pflanzlichen Zellwandpolymere in drei Hauptkategorien eingeteilt: Zellulose, Hemizellulosen und Pektine [1]. Zellulose ist mit einer Zugkraft gleich der von Stahl die größte tragende Komponente in der Zellwand. Mutationen der Zellulosesynthasen oder assoziierter Proteine sind für die Pflanze verheerend. Zellulose besteht aus ineinander verdrillten Glukoseketten, die über Wasserstoffbrückenbindungen zu einem rigiden Kabel gebündelt werden, das als Mikrofibrille bezeichnet wird. Diese Mikrofibrillen werden durch Enzymkomplexe synthetisiert, die sich in der Zellmembran befinden (Zellulosesynthase-Komplexe oder CesAs).
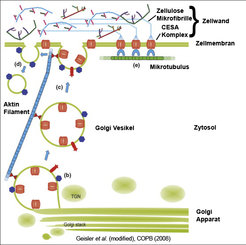
Mindestens drei verschiedene CesA-Untereinheiten werden für einen funktionellen Komplex benötigt. Dieser wird in der Zelle im Golgi-Apparat zusammengesetzt und dann zur Zellmembran transportiert. Ein drittes Kompartiment bildet ein Bindeglied zwischen dem Transport der CesAs innerhalb der Zelle und ihrem Einbau in die Zellmembran. Es wird als smaCC oder MASC (small CesA compartement oder Microtubule Associated CesA Compartement [2]; [3]) bezeichnet. Zelluloseproduktion beinhaltet somit die Zusammensetzung der CesAs im Golgi-Apparat, ihren Transport bis zur Zellmembran über smaCCs/MASCs und ihren Einbau in die Zellmembran, wo sie ihre Funktion ausüben (Abb. 1).
Das pflanzliche Zytoskelett
Das Zytoskelett ist ein flexibles Gitter, welches das Zytoplasma nahezu jedes lebenden Organismus umspannt. Es besteht aus einem filamentösen Netzwerk, das zwei grundlegende Strukturen beinhaltet: Aktinfilamente und Mikrotubuli [5]. Dieses Netz ermöglicht viele lebenswichtige Prozesse, die dem Wachstum und der Entwicklung des Organismus zu Grunde liegen. Dazu gehören Vesikeltransport, gerichtete Zellexpansion und Zellteilung in pflanzlichen und tierischen Zellen. Die Bestandteile des Zytoskeletts sind in Pflanzen und Tieren ähnlich. Jedoch ist das pflanzliche Zytoskelett im Gegensatz zum tierischen ausschließlich für die räumliche Form der Zelle verantwortlich und nicht zusätzlich für ihre Bewegung. Die Mikrotubuli und Aktinfilamente wurden bisher als unabhängige Strukturen mit jeweils spezifischen Funktionen angesehen. Neueste Erkenntnisse unterstützen jedoch die These, dass sich Aktin- und Mikrotubuli-Zytoskelett in tierischen Zellen gegenseitig beeinflussen können. Im Gegensatz dazu ist für Pflanzenzellen bisher wenig über eine solche Interaktion bekannt.
Das Zytoskelett als Transportmittel für CesAs
Der Transport der CesA-Komplexe vom Golgi-Apparat über die smaCC/MASCs zur Zellmembran benötigt sowohl Aktinfilamente als auch Mikrotubuli. Um einen reibungslosen Ablauf des Transports zu gewährleisten, ist es wahrscheinlich, dass die beiden Komponenten des Zytoskeletts zusammenwirken. Um das Zusammenspiel von Aktin und Mikrotubuli zu erforschen, wurden Pflanzen so verändert, dass sie fluoreszierende Proteine bilden, die sowohl Aktin als auch Mikrotubuli im Mikroskop sichtbar machen. Mithilfe dieser Pflanzen und hochauflösender Fluoreszenzmikroskopie konnten beide Komponenten simultan in lebenden Zellen sichtbar gemacht werden. Interessanterweise zeigte sich, dass Aktinfilamente, die sonst sehr dynamisch sind, kurzzeitig starr werden, sobald sie auf Mikrotubuli stoßen. Außerdem wurde gezeigt, dass Aktin und Mikrotubuli einander benötigen, um ein neues Netzwerk aufzubauen, sobald es beschädigt wird. Diese Ergebnisse belegen, dass auch in Pflanzenzellen eine Interaktion bzw. Kooperation zwischen Aktin- und Mikrotubuli-Zytoskelett stattfindet.
Um einen effizienten Transport von Zellbestandteilen wie z. B. CesA-Komplexen vom Golgi-Apparat zur Zellmembran zu gewährleisten, ist es wichtig, ein gut organisiertes logistisches Netzwerk zur Verfügung zu haben. Bei der Analyse des Zytoskeletts wurde gezeigt, dass keine der beiden Zytoskelett-Komponenten allein ausreicht, um den Transport der zellulären Ladung effizient umzusetzen. Erst die Zusammenarbeit von Aktin- und Mikrotubuli-Zytoskelett ermöglicht einen reibungslosen Transport. Es stellt sich nun die Frage: Nutzen die CesAs auf ihrem Weg zur Zellmembran beide Zytoskelett-Komponenten? Tatsächlich bewegen sich die Golgi-Vesikel mit hoher Geschwindigkeit eng am Aktin-Zytoskelett entlang. Zerstört man die Aktinfilamente, reißt der Strom der Golgi-Vesikel ab und sie lagern sich zu Aggregaten zusammen [2]. Weiterhin sind smaCCs/MASCs, wie ihr Name schon verrät, weitgehend mit Mikrotubuli assoziiert. Somit gibt es Grund zur Annahme, dass, während Golgi-Vesikel über Aktin-Highways in der Zelle verteilt werden, die kleineren smaCCs/MASCs auf Mikrotubuli zurückgreifen, um ihre Ladung an die Zellmembran zu übergeben. Das so optimierte zelluläre Logistiknetzwerk ist folglich von höchster Bedeutung für die schnelle und exakte Verteilung der CesAs in pflanzlichen Zellen.
Das Zytoskelett leitet die CesA-Komplexe in der Zellmembran
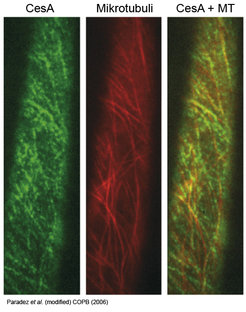
Aufgrund der Stärke der Zellulose-Mikrofibrillen ist die räumliche Orientierung ihrer Synthese entscheidend für die Morphologie der Zelle und der gesamten Pflanze. Soll sich eine Zelle etwa in Längsrichtung strecken, müssen die Seitenwände durch eine Art Zellulose-Korsett verstärkt werden. Die räumliche Orientierung der neu synthetisierten Zellulosefibrillen bestimmt das darunterliegende Zytoskelett mit den Mikrotubuli [6]. Bereits in den sechziger Jahren beschrieben Wissenschaftler, dass Zellulosefibrillen in der Regel parallel zu Mikrotubuli angeordnet sind. Jedoch konnte erst im Jahr 2006 durch Paredez et al. überzeugend gezeigt werden, dass CesA-Komplexe sich während der Zellulosesynthese an Mikrotubuli entlangbewegen, hierzu wurde die Technik des live cell imaging eingesetzt (Abb. 2). Bis heute gibt es jedoch noch keine Vorstellung für den Mechanismus, der dieser Interaktion zu Grunde liegt.
In Zusammenarbeit mit US-amerikanischen Wissenschaftlern wurde nun ein Protein entdeckt, das mit den CesA-Komplexen interagiert und die Zellulosesynthese stört, wenn es nicht funktionell vorhanden ist [7]. Dieses Protein wurde Cellulose Synthase Interacting 1 (CSI1) genannt und wird nur in Pflanzen produziert. Interessanterweise enthält CSI1 viele Sequenzmotive, die wahrscheinlich eine Mikrotubuli-Interaktion gewährleisten könnten (Abb. 3). Eine Verbindung zwischen dem CSI1-Protein und den Mikrotubuli wird auch dadurch gestützt, dass Mutationen in diesem Protein zu typischen Mikrotubuli-Mangelerscheinungen führen, wie z. B. verdrilltes Wachstum.
Perspektiven

Das Aktin- und Mikrotubuli-Zytoskelett ist von enormer Wichtigkeit für alle lebenden Organismen. Neue Erkenntnisse zur Architektur und zum dynamischen Verhalten der kombinierten Zytoskelettstrukturen werden das Verständnis darüber erhöhen, wie Transportprozesse zu unterschiedlichen Orten in der Zelle effizient umgesetzt werden. Ein wichtiger Aspekt ist weiterhin die Verknüpfung dieses Transports mit der Zellulosesynthese. In Anbetracht der Bedeutung von Zellulose für Industrie und Gesellschaft, die inzwischen auch die Produktion von Bioethanol einschließt, ist ein grundlegendes Verständnis darüber, wie dieses Polymer synthetisiert wird von stetig wachsender Bedeutung.


