Sauerstoff in Pflanzen – wie ein Lebenselixier gleichzeitig Stressfaktor und Signalstoff sein kann
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Molekulare Pflanzenphysiologie
Niedrige Sauerstoffkonzentration als Stressfaktor für Pflanzen
Sauerstoff ist für Pflanzen, wie für viele andere Organismen, eine lebenswichtige Komponente. Er spielt eine essenzielle Rolle in der Atmung und ist darüber direkt mit der Energieversorgung der Zelle verbunden. Während die grünen Teile der Pflanzen mittels Photosynthese selber Sauerstoff produzieren, ist die Sauerstoffversorgung der Wurzeln abhängig von der Sauerstoffzufuhr aus der Umgebung. Da Pflanzen keinen aktiven Transportmechanismus für Sauerstoff haben, sondern von der Diffusion abhängig sind, kann es unter bestimmten Umständen zu einem Sauerstoffmangel im Pflanzengewebe kommen. Dieser Zustand wird Hypoxie genannt. Kommt es zusätzlich zu einer verminderten Sauerstoffversorgung von außen – zum Beispiel durch Wassersättigung des Bodens, die zur Hemmung des Gastransports im Boden führt –, kann im Pflanzengewebe die Sauerstoffkonzentration so stark abfallen, dass eine optimale Energieversorgung der Zelle nicht mehr möglich ist. Dies kann zum Absterben der Pflanze führen, wie jeder weiß, der einmal seine Zimmerpflanze zu stark gegossen hat.

Damit Pflanzen Schwankungen der Sauerstoffkonzentration nicht sofort mit dem Tod bezahlen müssen, steht ihnen eine Vielzahl von Anpassungsstrategien zur Verfügung. Beispielsweise gibt es morphologische Anpassungen in Form von Luftwurzeln oder Aerenchymen, durch deren Bildung die Versorgung der Zellen mit Sauerstoff verbessert wird. Eine solche morphologische Anpassung benötigt jedoch Zeit, da zum Teil neue Gewebestrukturen gebildet werden müssen und Zellteilungsprozesse notwendig sind. Zudem sind nicht alle Pflanzenarten in der Lage, Aerenchyme zu bilden.
Eine andere, sofort wirksame Strategie besteht in der Anpassung des Stoffwechsels an die Sauerstoffmangelsituation und die daraus resultierende verminderte Energieverfügbarkeit. Über diese Fähigkeit verfügen unter anderem Pflanzenarten wie Reis, Kartoffel, Weizen, Soja, Pappel und Arabidopsis [1]. Diese Flexibilität des Stoffwechsels bildet eine wichtige Voraussetzung dafür, Perioden mit niedriger Sauerstoffversorgung zu überleben [2].
Damit Pflanzen auf Schwankungen des Sauerstoffgehaltes reagieren können, müssen sie diese Änderungen der Sauerstoffkonzentration rechtzeitig wahrnehmen. Obwohl seit vielen Jahren Anstrengungen unternommen wurden, den Mechanismus der Sauerstoffdetektion (Oxygen sensing) in Pflanzen zu entdecken, gelang der Nachweis dieses Prozesses erst im letzten Jahr [3]. Mit dieser Entdeckung gehört Hypoxie zu einer der wenigen abiotischen Stressarten, für die nun ein Sensor bekannt ist und die Signalwege und Anpassungsstrategien in Pflanzen beschrieben wurden.
Regulation der Energiestoffwechselwege
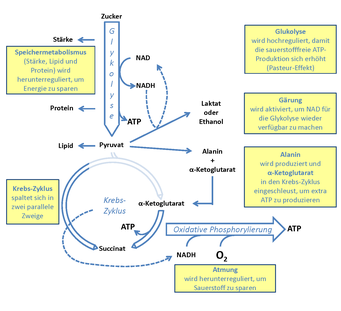
Um die Regulation des Energiemetabolismus während Hypoxia zu verstehen, reicht es nicht aus, die Atmung oder die oxidative Phosphorylierung in den Mitochondrien zu erforschen, sondern es müssen die gesamten Stoffwechselwege der Glykolyse und des Krebszyklus in die Untersuchungen eingeschlossen werden.
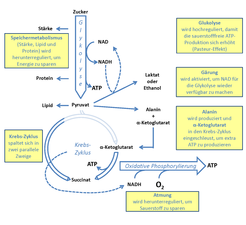
Abbildung 2 stellt die wichtigsten Stoffwechselwege schematisch dar und zeigt, wie diese von einer niedrigen Sauerstoffkonzentration beeinflusst werden. Wenn Sauerstoff als Substrat für die oxidative Phosphorylierung fehlt, kann dies dazu führen, dass zu wenig Energie in Form von Adenosintriphosphat (ATP) bereitgestellt wird. Die bekannteste Reaktion des Kohlenstoffmetabolismus darauf ist der sogenannte Pasteur-Effekt, benannt nach Louis Pasteur, der dieses Phänomen als erster an Hefe beschrieben hat [4]. Dabei wird die Aktivität der Glykolyse erhöht, allerdings nicht, um Substrat für den Krebszyklus zu erzeugen, sondern um die Produktion von ATP zu steigern. Bei dieser Reaktion wird auch Nicotinamid-Adenin-Dinukleotid (NAD) zu NADH reduziert. Damit das NAD als Nebensubstrat der Glykolyse nicht ausgeht, sorgen Gärungsreaktionen dafür, dass NADH wieder in NAD zurückgeführt wird. Dabei entsteht in höheren Pflanzen unter anderem Ethanol oder Laktat. Auf diese Weise sind Zellen in der Lage bei Sauerstoffmangel, unter Verbrauch relativ großer Kohlenhydratmengen, ausreichend ATP für die lebenswichtigsten Prozesse zu produzieren.
Interessanterweise wird der Sauerstoffverbrauch bei der Atmung bereits bei Konzentrationen reduziert, die noch nicht erwarten lassen, dass der Sauerstoff einen limitierenden Faktor darstellt [5]. Daraus kann geschlossen werden, dass es zusätzliche Regulationsmechanismen geben muss, die bereits frühzeitig dafür sorgen, dass sparsamer mit Sauerstoff umgegangen wird.
Ein Beispiel für die dynamische Reaktion des primären Stoffwechsels auf eine verminderte Sauerstoffkonzentration besteht in einer „Umleitung“ des Kohlenstoffflusses. Diese Umleitung führt dazu, dass die Produktion der Aminosäure Alanin und der organischen Säure Alpha-Ketoglutarat erhöht wird [6] und dadurch der Krebszyklus weniger Substrat bekommt. In Folge wird weniger NADH gebildet, mit welchem normalerweise unter Verwendung von Sauerstoff ATP produziert wird. Die Abnahme der Aktivität des Krebszyklus könnte daher eine Ursache dafür sein, dass die Atmungsrate während niedriger Sauerstoffbedingungen abnimmt.
Eine weitere Änderung des Atmungsmetabolismus, die in Experimenten beobachtet wurde, ist die Umstrukturierung der Verknüpfung von Proteinkomplexen in der mitochondrialen Membran [7]. Normalerweise bilden sich die verschiedenen Proteinkomplexe, die an der oxidativen Phosphorylierung beteiligt sind, gemeinsam in sogenannten Superkomplexen. Unter Niedrigsauerstoff-Bedingungen fallen diese Superkomplexe jedoch auseinander und ermöglichen damit die Beteiligung von alternativen Stoffwechselwegen der Atmung. So ist es zum Beispiel möglich, NADH, das durch die Glykolyse statt durch den Krebszyklus produziert wurde, für die oxidative Phosphorylierung zu verwenden. Diese Reorganisation der Stoffwechselwege könnte ebenfalls dazu beitragen, dass die Aktivität des Krebszyklus herunterreguliert wird.
Sauerstoff-Sensing
Obwohl eine große Vielfalt an Anpassungsstrategien bekannt ist, die dazu beitragen, die Auswirkungen des Sauerstoffstresses in Pflanzen zu minimieren, gab es bis vor kurzem keine Hinweise darauf, wie Pflanzen die Sauerstoff-Verfügbarkeit in den Zellen detektieren. Wiewohl für Tiere und Mikroorganismen bereits mehrere unterschiedliche Sensorsysteme beschrieben wurden, mutmaßte man, dass es für Pflanzen möglicherweise gar keinen Sauerstoffsensor gibt, sondern dass eher die Auswirkungen des Stresses, ein niedriger Energiestatus oder eine Übersäuerung der Zelle detektiert werden und so die Reaktion auf Niedrigsauerstoff-Bedingungen ausgelöst wird.
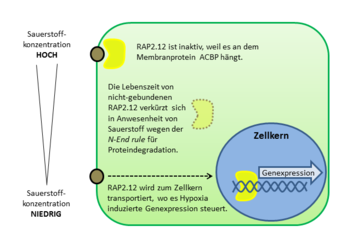
Während der letzten fünf Jahre wurde jedoch mehrfach beschrieben, dass Proteine daran beteiligt sind, die zu der Familie der ERF-Transkriptionsfaktoren (Ethylene Response Factor) gehören [8]. Diese Transkriptionsfaktoren zeichnen sich durch eine charakteristische Aminosäuresequenz am Anfang des Proteins aus, dem sogenannten N-Ende, die über Stabilität und Lebensdauer des Proteins bestimmt. Die von der Aminosäuresequenz festgelegte Reaktionsreihe, die zum Abbau des Proteins führt, ist bekannt als N-end rule. Ein sehr wichtiger Schritt in dieser Reaktionsreihe ist die Reaktion der Aminosäure Cystein mit molekularem Sauerstoff. Daraus ergibt sich, dass die Lebenszeit des Transkriptionsfaktors und damit dessen Aktivität als Regulator der Genexpression von der Sauerstoffkonzentration in der Zelle bestimmt wird.
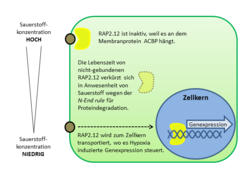
Ein Transkriptionsfaktor, RAP2.12, der zur Familie der ERF gehört, hat sich für die Regulation der Niedrigsauerstoff-Rreaktion in Pflanzen als besonders wichtig herausgestellt [3]. Er befindet sich unabhängig von der Sauerstoffkonzentration normalerweise in der Plasmamembran, wo er als Transkriptionsfaktor nicht aktiv sein kann (Abb. 3).Verantwortlich für die ungewöhnliche Lokalisierung des Proteins ist die Bindung an das Membranprotein ACBP. Die Interaktion zwischen diesen beiden Proteinen sorgt gleichzeitig dafür, dass RAP2.12 gegen die Degradierung geschützt wird, die eigentlich nach der N-end rule zu erwarten wäre. Durch einen noch nicht geklärten Mechanismus lässt ACBP den Transkriptionsfaktor RAP2.12 nur dann los, wenn die Sauerstoffkonzentration sinkt. Nur dann wird er in den Zellkern transportiert, um dort die lebenswichtigen Gene zu exprimieren, die unter Niedrigsauerstoff-Konditionen aktiv werden. Dadurch dass RAP2.12 immer in der Zelle vorliegt und nicht erst produziert werden muss, wenn die Sauerstoffkonzentration sinkt, ist eine schnelle Reaktion auf Änderungen der zellulären Sauerstoffkonzentration garantiert. Die Regulation der Lebenszeit, und damit die Aktivität des Proteins, wird dann über die N-end rule für Proteindegradation feinreguliert, sodass die Stressreaktion der Pflanze an die aktuelle Sauerstoffverfügbarkeit angepasst werden kann.
Obwohl eine der wichtigsten Fragen bezüglich der Regulation der Stressreaktion auf niedrige Sauerstoffkonzentrationen in Pflanzen mit der Entdeckung des Sauerstoffsensors geklärt ist, bleiben noch viele Fragen offen und neue Fragen ergeben sich. So muss zum Beispiel geklärt werden, ob und wenn ja, wie die Reaktion von molekularem Sauerstoff mit Cystein in dem N-Terminus des ERF-Transkriptionfaktors von einem weiteren Enzym katalysiert wird. Auch stellt sich die Frage, ob der Sauerstoffsensor in der Lage ist, alle metabolischen Anpassungen zu steuern. Eventuell gibt es nicht nur eine, sondern mehrere verschiedene Sauerstoffsensorsysteme in Pflanzen, ähnlich wie sie bereits für Tiere bekannt sind. Ein weiterer Aspekt betrifft die Möglichkeit, die neuen Erkenntnisse in die Praxis umzusetzen, um zukünftig Kulturpflanzen besser vor den Auswirkungen von Sauerstoffmangel bei Staunässe oder Überflutung zu schützen und dadurch Ernteverluste deutlich zu reduzieren.