Mobile RNA - senden Pflanzenzellen eine doppelte Botschaft?
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für Molekulare Pflanzenphysiologie
Kommunikation und das interzellulare Signalkonzept
Die beiden Begriffe Kommunikation und Signal werden in der Biologie vielfach doppeldeutig verwendet. Am Beispiel des in den 1940er-Jahren von Shannon und Weaver entwickelten klassischen Kommunikationsmodells kann der Unterschied relativ einfach verdeutlicht werden. Demnach wird von einem Sender eine Nachricht - man könnte auch Signal sagen - verschickt, die sich an einen Adressaten wendet. Eine Kommunikation wird als erfolgreich gewertet, wenn der Empfänger der Nachricht zu verstehen gibt, dass er die Information beziehungsweise das Signal erhalten hat, also eine Rückmeldung oder ein Feedback an den Sender gibt. Aber so einfach ist es eben nicht immer, es gibt dabei nämlich auch Unschärfen. Ist beispielsweise mein Nachbar zu laut und ich beschwere mich deshalb bei ihm, der Störenfried aber nicht reagiert, sondern im Gegenteil weiter lärmt, so könnte man annehmen, dass mein Signal bei ihm nicht angekommen ist und keine Kommunikation zustande gekommen ist. Möglich ist aber auch, dass mein Nachbar meine Beschwerde zwar registriert hat, dann aber entscheidet, sie zu ignorieren. In diesem Falle ist nicht erkennbar, ob ein bewusster Entscheidungs- und Reaktionsprozess, also Kommunikation, stattgefunden hat.
Ähnlich schwierig ist es auch, biologische Informationsprozesse einzuordnen. Da bisher viele der Signale, die ausgesandt werden, noch nicht bekannt sind und auch nicht diejenigen Prozesse, die sie beim Empfänger auslösen, können sie auch nicht einfach als Signal- oder als Kommunikationsweg eingeordnet werden. Die Forschungsgruppe Interzellulärer Makromolekularer Transport in Pflanzen beschäftigt sich mit der Charakterisierung der Transportmechanismen und Funktionen von Proteinen und RNA-Molekülen, die sich zwischen Zellen bewegen, um mehr Licht in die Funktion von Signalen zu bringen.
Wie komplex sind die Signale und woher kommen sie?
So wie tierische Organismen Blutgefäße nutzen, brauchen auch Pflanzen Leitgefäße, um Nährstoffe zu entfernten Geweben zu transportieren. Wir unterscheiden hauptsächlich zwischen zwei Leitgeweben: dem Xylem und dem Phloem, die beide zu vaskulären Bündeln vereint sind. Zuckermoleküle und Aminosäuren werden von ihrem Entstehungsort in den fotosynthetisch aktiven Blättern durch das Phloem in die Wurzelgewebe und zu den Blüten transportiert. Das Xylem versorgt die Blätter und Blüten mit Wasser und mit Nährstoffen, wie Nitrat und Phosphat, die von den Wurzeln dem Erdboden entnommen werden. Verglichen mit dem tierischen kardiovaskulären System, welches zirkulär und in sich geschlossen ist, sind die pflanzlichen Leitbündelsysteme offen, das heißt, sie enden in den Geweben und man weiß so gut wie nichts über die Entsorgung oder ein mögliches Recycling von überschüssigen Metaboliten und Schadstoffen, die ebenso über die Leitbündel transportiert werden.
Viel weiß man über Wachstumshormone, die über das Phloem transportiert werden und als Signale in den Zellen der entfernten Gewebe erkannt werden. Ob hormonelle Signale ausreichend sind, um die Kommunikation zwischen den Geweben zu steuern, ist fraglich und wird oft diskutiert. Auch hier ist, wie schon erwähnt, die oftmals synonyme Verwendung der Begriffe Signal und Kommunikation nicht hilfreich.
Als weitere Signale fungieren Zuckermoleküle wie Saccharose und Trehalose, die relativ unspezifisch Gewebewachstum oder Blütenbildung beeinflussen. Aber im Phloemsaft finden sich auch wesentlich komplexere und spezifischere Signalmoleküle. So wurden kleine silencing Ribonukleinsäuren (siRNAs) und Signalpeptide gefunden, die meist aus rund zwanzig Nukleotiden beziehungsweise rund zwanzig Aminosäuren bestehen. Durch deren hohe Variabilität und der dadurch bedingten komplexen Struktur können diese Moleküle als hochspezifische regulatorische Signale agieren. Besonders interessant sind die siRNAs, weil sie an messenger RNA (mRNA) und möglicherweise auch an genomische DNA binden, wenn diese spezifische Bindungssequenzen aufweisen (Abb. 1). Dadurch unterdrücken beziehungsweise variieren sie deren Funktion. Die Bindung von siRNA an mRNA führt zu deren Abbau und verhindert so, dass die mRNA in ein Protein übersetzt wird. Dies bedeutet, dass im Phloem transportierte siRNAs hochspezifisch bestimmte mRNAs, zum Beispiel die RNA von Pathogenen, sogar in weit entfernten Geweben regulieren können. Die in Blättern produzierten siRNAs werden über große Distanzen - in Bäumen über mehrere Meter - zu den Wurzeln, Blüten beziehungsweise Früchten transportiert.
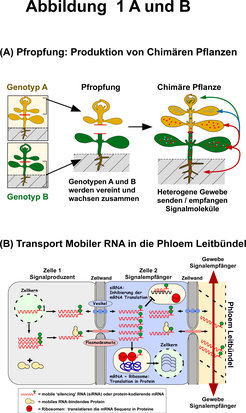
Was das Signalsystem noch komplizierter macht ist, dass Pflanzen ein weiteres RNA-basierendes Signalsystem besitzen. Sie verwenden nicht nur kleine siRNAs, sondern auch proteinkodierende mRNAs als Signale. Überraschend viele (mehr als 2000) individuelle mRNAs wurden im Phloemsaft entdeckt, von denen einige in ganz bestimmte Bereiche der Pflanzen transportiert werden. Wie diese mRNAs als mobile Signale erkannt oder aktiv werden und warum sie überhaupt transportiert werden, ist so gut wie unbekannt. Einige scheinen eine bestimmte dreidimensionale Struktur zu haben, die sie als mobile RNAs kennzeichnen. Die mobile mRNA wird erst in den Empfängerzellen in funktionelle Proteine übersetzt [1]. Wir können nur vermuten, warum so viele - ein Fünftel aller produzierten mRNAs - in ferne Gewebe transportiert werden und ob sie eine spezifische Signalfunktion erfüllen. Aber wir wissen, dass viele mobile mRNAs zwischen den Pflanzenfamilien konserviert sind und zum Beispiel in Broccoli, Kürbis, Weinreben und Ackerschmalwand vorkommen [2, 3]. Auch gibt es Hinweise darauf, dass bestimmte mobile mRNAs nicht nur über das Phloem von den Blättern in die Wurzeln transportiert werden, sondern auch in die entgegengesetzte Richtung von den Wurzeln in die Blätter. Wahrscheinlich nutzten sie die pflanzentypischen, kleinen interzellularen Kanäle, die Plasmodesmata, um von Zelle zu Zelle zu wandern und dadurch entfernte Gewebe erreichen.
RNA Signale in der Pflanzenzucht
Auch wenn es nicht immer offensichtlich ist, sind mobile RNA Signale in der Pflanzenzucht von großer Bedeutung. Es ist nur wenig bekannt, dass nicht nur Weintrauben, sondern viele Früchte, die wir essen, beispielsweise Tomaten, Kürbisse oder Gurken und viele andere zweikeimblättrige Arten, von gepfropften, das heißt veredelten Pflanzen geerntet werden. Diese Pflanzen sind Chimären, da sie aus zwei verschiedenen Genotypen oder Varietäten bestehen. Ein Wurzelstock, auch Unterlage genannt, wird mit einem Ableger vereint (Abb. 2). Nach einiger Zeit wachsen die Gewebe zusammen und die Leitbündel vereinen sich zu einem chimären Gewebe. Die blüten- oder früchtetragenden Teile wurden mit einen fremden Wurzelstock verbunden und vereinigen sich zu einem Individuum.
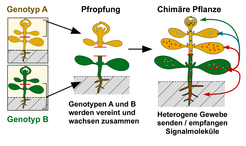
Aber warum wird diese uralte Agrartechnik, die vermutlich schon zur Zeit der Pharaonen im alten ägyptischen Reich bekannt war, bis heute erfolgreich angewendet? Bei Weinreben ist es der Schutz vor Rebläusen, die die Wurzeln von Edelsorten befallen. Durch Pfropfung werden Weinstöcke produziert, deren Wurzeln resistent gegen den Reblausbefall sind. Bei Rosen oder anderen Kulturpflanzen geht es meist um die Bildung größerer Blüten oder einen höheren Ertrag, weil die Wurzelstöcke bestimmter Genotypen besser Nährstoffe aus den Boden aufnehmen können, bessere Resistenz gegen Viren- oder Bakterienbefall oder höhere Trockenresistenz zeigen oder der Blütezeitpunkt besser an die lokalen klimatischen Bedingungen angepasst ist.
Interessanterweise sind nicht alle genotypischen Kombinationen innerhalb einer Art kompatibel, zum Beispiel können einige Weintrauben-, Kürbis- oder Tomatensorten nicht miteinander gepfropft werden oder sie wachsen nach der Veredelung extrem langsam. Im Weinbau ist es eines der wertvollsten Betriebsgeheimnisse, welche Edelsorten miteinander kombinierbar sind und sowohl einen optimalen Ertrag als auch einen guten Weingeschmack produzieren. Warum aber gewisse Kombinationen nicht zu dem gewünschten Resultat führen, ist meist unbekannt und wird anekdotenhaft mit nicht kompatiblen Wachstumssignalen, die zwischen den gepfropften Sorten ausgetauscht werden, erklärt. Wahrscheinlich spielen hier Hormonaustausch und mobile RNA Signale eine wesentliche Rolle. Soweit bekannt ist, wird in Chimären die Produktion von Proteinen in entfernteren Geweben durch mobile siRNA verändert, was sowohl zu positiven als auch zu negativen Wachstumseffekten oder aber Resistenzen gegen Pathogene führen kann.
Eine andere Anwendung der Veredelung ist die Steuerung des Zeitpunkts der Blüte und der Fruchtproduktion. Ein Experiment zeigte, dass in den Blüten von Pflanzen, die nicht gentechnisch verändert, aber auf gentechnisch veränderte Unterlagen gepfropft wurden, transgen produzierte mobile mRNA importiert und durch diese mRNA die Pollenbildung aktiv verhindert werden konnte [1]. Das Wachstum von nicht-transgenen Blüten oder Früchten, so das Ergebnis, kann also mittels Veredelung durch transgene Pflanzen hochspezifisch verändert werden. Diese Technik wird voraussichtlich bald in der Züchtung Anwendung finden. Weil dabei keine transgenen Pflanzenteile für die Ernährung produziert werden, ist damit zu rechnen, dass die Ernteprodukte vor Inverkehrbringen nicht unter die restriktiven Regelungen des Gentechnikgesetzes fallen.

