Lebensdauer von Photosynthesekomplexen in höheren Pflanzen
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Molekulare Pflanzenphysiologie
Chloroplasten und Photosynthese
In der Photosynthese nutzen Pflanzen die Energie des Sonnenlichts, um CO2 zu fixieren und daraus organische Verbindungen aufzubauen. Gleichzeitig wird Wasser oxidiert, sodass molekularer Sauerstoff entsteht. Diese Reaktionsabfolge ist in den Chloroplasten lokalisiert und kann in zwei Teilschritte untergliedert werden: die lichtabhängigen Reaktionen des photosynthetischen Elektronentransports, die in den Thylakoidmembranen ablaufen und Reduktionsmittel in Form von NADPH sowie chemische Energie in Form von ATP für die CO2 Assimilation bereitstellen, und die im Stroma der Chloroplasten ablaufenden Reaktionen des Calvin-Zyklus. Der Calvin-Zyklus assimiliert CO2 zu Kohlenhydraten, wobei ATP und NADPH verbraucht werden.
ATP und NADPH: Zuviel ist schädlich
In Abhängigkeit von den Umweltbedingungen kann sich die Aktivität des Calvin-Zyklus ändern, sie nimmt beispielsweise bei Trockenstress oder Kälte dramatisch ab. Aber auch während der Blattentwicklung unterliegt die Aktivität deutlichen Änderungen. So ist die Calvin-Zyklus-Aktivität in jungen, noch wachsenden Blättern sehr gering, da sich der Photosynthese-Apparat erst aufbaut. Daher werden junge Blätter von älteren Blättern mit Assimilaten versorgt. Mit zunehmendem Blattalter übersteigt dann die Assimilationskapazität den Eigenbedarf der Blätter und sie fangen an, Assimilate zu exportieren. Damit werden dann Gewebe, die sich nicht ausreichend selber versorgen können, gefüttert. Diese Gewebe werden Sink-Gewebe genannt. Zwischen verschiedenen Arten gibt es große Unterschiede in der Calvin-Zyklus-Aktivität der ausgewachsenen Blätter. So halten zum Beispiel Sonnenblumen (Helianthus annuus) über mehrere Wochen eine hohe Assimilationskapazität der Blätter aufrecht, da die sich entwickelnden Blütenkörbe einen hohen Assimilatbedarf haben, den sie selber nicht decken können. Im Unterschied dazu nimmt beim Tabak (Nicotiana tabacum) die Assimilationskapazität unmittelbar nach Erreichen des vollständig ausgewachsenen Zustands des Blattes langsam ab. In diesem Fall reichen die jüngsten ausgewachsenen Blätter aus, den Photoassimilat-Bedarf der Sink-Gewebe zu decken [1].
Eine abnehmende Aktivität des Calvin-Zyklus führt zu einem niedrigeren Verbrauch von ATP und NADPH. Um einen damit verbundenen massiven Elektronenabfluss auf alternative Akzeptoren, vor allem molekularen Sauerstoff, zu vermeiden, muss der photosynthetische Elektronentransport gedrosselt werden. Anderenfalls käme es zu einer erhöhten Produktion reaktiver Sauerstoffspezies (ROS), die den Photosynthese-Apparat zerstören und Zelltod-Prozesse verursachen könnten. Daher ist es für die Lebensfähigkeit der Pflanze von entscheidender Bedeutung, die Kapazität der photosynthetischen ATP und NADPH-Produktion an den jeweiligen Bedarf anzupassen [1].
Zwei Proteinkomplexe regeln den photosynthetischen Elektronentransport
Die Anpassung des photosynthetischen Elektronentransports an den Bedarf wird vor allem durch Änderungen der Gehalte von zwei Proteinkomplexen in der Thylakoidmembran erzielt: Zum einen wird der Gehalt des Cytochrom b6f Komplexes (b6f), der den Raten-limitierenden Schritt des photosynthetischen Elektronentransports katalysiert, angepasst, zum anderen ist auch der Gehalt der plastidären ATP Synthase strikt reguliert. Letzterer Enzymkomplex nutzt die durch den photosynthetischen Elektronentransport aufgebaute Protonen-motorische Kraft für die Synthese von ATP. Die Gehalte beider Komplexe können sich während der Blattentwicklung oder in Anpassung an Stress um mehr als den Faktor zehn ändern [1].
Bisher ist noch nicht klar, wie genau die Gehalte beider Komplexe an den Bedarf angepasst werden. Weder ist eindeutig geklärt, welche Signale ihre Anpassung auslösen, noch, ob die Komplexgehalte primär über eine veränderte Biogenese oder über einen veränderten Abbau reguliert werden. Eine Steuerung auf der Ebene der Biogenese könnte durch Änderungen in der Transkription oder Translation der verschiedenen Untereinheiten eines Komplexes erfolgen. Die Situation wird allerdings dadurch kompliziert, dass die verschiedenen Untereinheiten der Photosynthese-Komplexe in unterschiedlichen zellulären Kompartimenten kodiert sind - zum einen im Zellkern, zum anderen in den Chloroplasten. Die Kern kodierten Untereinheiten werden im Cytosol translatiert und dann in den Chloroplasten transportiert, während die Plastiden kodierten Untereinheiten direkt in den Assemblierungsprozess eintreten können. Weiterhin könnte eine Regulation der Biogenese auch über eine veränderte Syntheserate essenzieller Kofaktoren und an der Assemblierung beteiligter Helferproteine, sogenannter Chaperone, erzielt werden. Eine Regulation auf der Ebene des Abbaus könnte vor allem durch die Synthese oder Aktivierung von Proteasen, die die Untereinheiten des Komplexes degradieren, erfolgen (Abb. 1; [2])
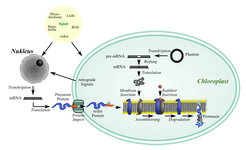
Abb.1: Biogenese und Degradation von Photosynthesekomplexen in höheren Pflanzen. Nähere Erläuterung im Text.
Die Lebensdauer der Photosynthesekomplexe
Je stabiler ein Komplex, das heißt, je länger seine Lebensdauer ist, desto mehr sollte sein Gehalt in ausgewachsenen Blättern durch Abbauprozesse bestimmt werden. Ist ein Komplex hingegen sehr instabil, so sind vor allem Aufbauprozesse für den Gehalt relevant. Erstaunlicherweise ist bisher nur sehr wenig über die Lebensdauer der verschiedenen Photosynthese-Komplexe bekannt. Nur für das Photosystem II, bei dem es sich um das bislang stärkste natürliche Oxidationsmittel handelt, ist bekannt, dass sein Reaktionszentrum, in dem H2O zu O2 umgewandelt wird, regelmäßig oxidativ geschädigt wird und einmal täglich, unter Stressbedingungen sogar bis zu einmal stündlich, ersetzt werden muss. Daten zur Lebensdauer des b6f, des Photosystems I oder der ATP Synthase liegen nicht vor. Es gibt allerdings Indizien, die auf eine hohe Stabilität dieser Komplexe hinweisen. Daher könnte ihre Biogenese auf junge, noch wachsende Blätter beschränkt sein, während sie in ausgewachsenen Blättern stark unterdrückt oder sogar komplett ausgeschaltet sein könnte [3]. Entsprechend können ausgewachsene Blätter ihre Assimilationskapazität normalerweise nicht wieder erhöhen, wenn der Bedarf der Sink-Gewebe plötzlich ansteigt. Auch zeigen ausgewachsene Blätter eine extrem eingeschränkte Kapazität, durch Stress geschädigte Komplexe zu ersetzen. Die einzige Ausnahme stellt geschädigtes Photosystem II dar, das unabhängig vom Blattalter innerhalb kurzer Zeit ersetzt werden kann. In Kooperation mit der Forschergruppe von Ralph Bock konnte gezeigt werden, dass der Gehalt essenzieller Chaperone der Photosystem I -Biogenese in ausgewachsenen Blättern massiv erniedrigt ist [4]. Zusammengenommen deuten diese Befunde sehr darauf hin, dass die Biogenese aller Komplexe – mit Ausnahme von Photosystem II – auf junge Blätter beschränkt ist und dass diese Komplexe daher sehr langlebig sein müssen.
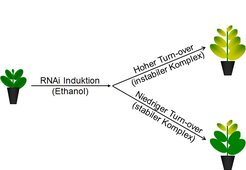
Um die Lebensdauer der Komplexe direkt zu bestimmen, wurde ein induzierbarer RNAi-Ansatz verwendet, um die Biogenese einzelner kernkodierter Untereinheiten jedes Photosynthese-Komplexes spezifisch zu unterdrücken [5]. Pflanzen wurden induziert, sobald der Photosynthese-Apparat der ältesten Blätter vollständig entwickelt war. In jungen, sich neu entwickelnden Blättern, die ihren Photosynthese-Apparat erst aufbauen, müsste diese Unterdrückung zu einem kompletten Verlust des Komplexes und damit des photosynthetischen Elektronentransports führen. In ausgewachsenen Blättern wiederum, deren Photosynthese-Apparat bereits vollständig entwickelt ist, sollten hingegen nur dann messbare Defekte der Photosynthese auftreten, wenn der reprimierte Komplex einen hohen turn-over aufweist. Falls der Komplex jedoch sehr stabil ist, so sollten vor der RNAi-Induktion komplett ausgewachsene Blätter keinerlei Photosynthese-Defekte entwickeln.
Zunächst wurde die Lebensdauer des b6f bestimmt [5]. Hierzu wurde die Synthese der beiden Kern-kodierten Untereinheiten unterdrückt. Wie erwartet, wiesen junge Blätter, die sich nach der RNAi-Induktion entwickelten, massive Defekte ihrer Photosynthese auf. In ausgewachsenen Blättern konnten selbst 14 Tage nach RNAi-Induktion keinerlei Unterschiede im b6f-Gehalt zwischen Wildtyp und den transformierten Pflanzen festgestellt werden (Abb. 2).
Sowohl im Wildtyp als auch in den induzierten RNAi-Varianten nimmt der Gehalt des Komplexes mit zunehmendem Blattalter ab. Diese Daten belegen, dass in ausgewachsenen Blättern keine signifikante de novo-Biogenese des b6f mehr stattfindet. Die Abnahme des Komplex-Gehalts könnte dabei entweder direkt seine Lebenszeit widerspiegeln oder es könnte sich um eine kontrollierte Degradation handeln, um die Kapazität des Elektronentransports an den mit zunehmendem Blattalter sinkenden Bedarf anzupassen.
Lediglich die Entfernung der Sprossachse oberhalb der ausgewachsenen Blätter konnte die Komplex-Biogenese reaktivieren und die Assimilationskapazität der ausgewachsenen Blätter steigern, da dies das erneute Austreiben des Sprosses unterstützen musste. Dies deutet auf eine Rolle systemischer Signale bei der Kontrolle der Komplex-Biogenese hin, mit deren Hilfe die Sink-Gewebe den sie versorgenden Blättern ihren Assimilat-Bedarf signalisieren. Kandidaten für solche systemischen Signale sind Phytohormone. Tatsächlich konnte durch die Applikation von Cytokinin die Biogenese des b6f re-induziert werden.
Neben dem b6f Komplex sind auch die ATP Synthase und das Photosystem I sehr stabil und weisen eine Lebensdauer von mehr als einer Woche auf. Diese Befunde stimmen mit Daten anderer Gruppen zur Lebensdauer bioenergetischer Komplexe der mitochondrialen Atmungskette überein. Auch für diverse Enzyme des pflanzlichen Primärstoffwechsels konnten in den vergangenen Jahren eine hohe Lebensdauer ermittelt werden [2]. Dies bedeutet, dass für ein umfassendes Verständnis der Anpassung der Photosynthese an unterschiedliche Umweltbedingungen und Entwicklungszustände die am Abbau der Komplexe beteiligten Faktoren zukünftig genauer charakterisiert werden müssen.

